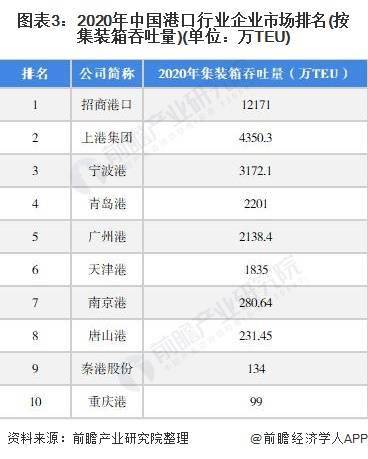
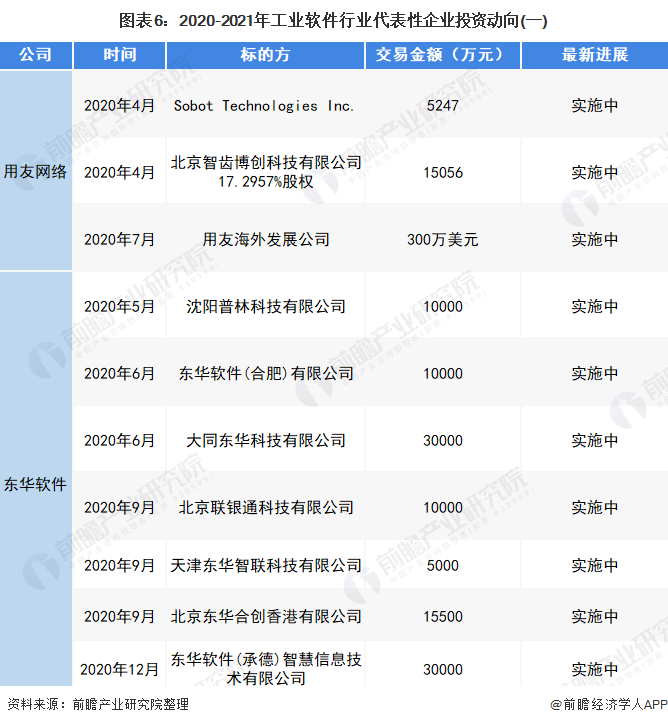
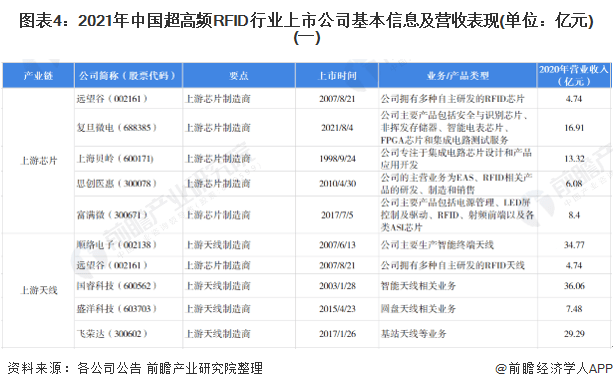
11月6日,美国食品药品监督管理局(FDA)召集的咨询委员会将讨论渤健(Biogen)和日本卫材(Eisai)的淀粉样蛋白抗体阿杜那单抗(aducanumab)用于治疗早期阿尔茨海默症的生物制品许可(BLA)申请,并投票决定是否向FDA推荐批准这款创新疗法。
在此之前,美东时间11月4日(周三),FDA在官网上公布了咨询委员会提供的背景资料,其中显示了不同FDA审评员对这一BLA的评估。该机构指出,渤健的实验性AD药物被证明有效,增加了其迅速获得批准的机会。
早在2019年10月22日,渤健和日本卫材(Eisai)宣布,在与FDA协商后,Biogen计划将在2020年初向FDA提交阿尔茨海默病药物aducanumab的生物制品许可上市申请,并将继续与欧洲、日本等地区的监管机构进行协商。
上述BLA提交的内容将包括来自I/Ib期研究的数据以及来自III期研究的完整数据。
彼时主导两项研究的PI、William B.和Sheila Konar精神病学、神经病学和神经科学教授,罗切斯特阿尔茨海默氏病大学护理研究和教育计划(AD-CARE)主任Anton Porsteinsson博士指出,这项III期研究庞大的数据集首次证明,清除聚集的Aβ蛋白可以减少阿尔茨海默氏病的临床下降,为医学界,患者及其家人提供了新的希望。
同在美国东部时间11月4日,2020年第13届阿尔茨海默病临床试验大会(CTAD)也传来消息,中国原研阿尔茨海默病新药、上海高新技术创新成果绿谷制药九期一®(甘露特钠胶囊)已经正式启动国际多中心Ⅲ期临床试验的患者入组工作,目前顺利完成国际临床试验全球第一例患者筛选。
据了解,九期一®已在位于美国纽约州锡拉丘兹市的科拉第(Clarity)临床研究中心顺利完成此次国际多中心Ⅲ期临床试验的第一例患者筛查。此次临床试验中40%的临床试验患者将来自中国,北美和欧洲参加临床试验的患者数量各占30%。根据计划,未来6个月将招募1/5的临床试验患者。
在本届CTAD大会的首日演讲中,美国阿尔茨海默病协会颁发的本特·温布拉德终身成就奖(2018)获得者、克利夫兰医学中心教授,九期一®国际多中心Ⅲ期临床试验方案主导设计者兼首席科学家杰弗里•库明斯介绍,该国际临床试验将是一项为期52周的多中心随机、双盲双臂、平行组安慰剂对照、单药疗法临床试验,它将在北美、欧洲和中国等14个国家和地区分别设立大约200家临床中心,涉及2046名轻度至中度阿尔茨海默病患者,试验组和安慰剂组各1023名。在双盲期之后,还将开展为期26周的开放试验。
《世界阿尔茨海默病2018年报告》显示,每3秒钟,全球就有一位痴呆症患者产生。全球目前至少有5000万的痴呆患者。到了2050年,这个数字预计将达到1.52亿。其中,有约60%-70%为阿尔茨海默病患者。然而与逐渐增加的患病人数相反,作为一种神经退行性疾病,阿尔茨海默病患者目前无法治愈,甚至治疗药物也相对缺乏。
据了解,阿尔茨海默病早在100多年前就被发现,但是,临床方面被认为缺乏较为有效的治疗手段,近20年来,全球范围内阿尔茨海默病的创新药品更是寥寥,研发过程并不顺利。根据美国药品研究与制造商协会发布的报告指出,1998年~2017年间,全球有146个阿尔茨海默病药物在临床研发中遭遇失败。截至目前,国际上仅有7种阿尔茨海默病药物获批准上市。
多年来各大制药巨头在阿尔茨海默病的研发上都有败北或放弃经历。如2013年辉瑞宣布放弃了抗体bapineuzumab的研发;2016年底礼来solanezumab在第三阶段试验中未能超过安慰剂的疗效;2017年初,默克承认BACE抑制剂verubecestat“几乎没有发挥作用”,遂取消二次尝试;2018年强生公司针对BACE抑制剂atabecestat的试验也搁置。
实际上,目前仍然有部分专家学者对aducanumab以及九期一的数据产生质疑,但市场对其仍有很大的期待,FDA将在明年3月对是否批准该药物做出最终决定,九期一®(甘露特钠胶囊)已经正式启动国际多中心Ⅲ期临床试验患者入组工作,目前顺利完成国际临床试验全球第一例患者筛选,这意味着九期一®已正式踏上国际化之路,全球阿尔茨海默病患者将有望用上来自中国的原研新药。